калькулятор-для-алгебри
Визначення молекулярної маси
Молекулярна маса
Молекулярна маса (також називається молекулярна вага, атомна вага молекули, формула маси та формульна вага) відноситься до комбінованої атомної ваги (також називають стандартною атомною вагою) атомів, що формують молекулу. Її можна знайти, помноживши кількість атомів кожного елементу на їх атомну вагу та додавши результати разом.Наприклад, містить два атоми водню, кожен з яких має атомну вагу 1.008 у, та один атом кисню з атомною вагою 15.999 у. Щоб знайти молекулярну масу , ми множимо атомні ваги водню на 2, оскільки в є два атоми водню, і нам потрібно знайти їхню комбіновану масу, та додаємо його до атомної ваги кисню, оскільки в є лише один атом кисню, для отримання 18.015 у.
Молекулярна маса вимірюється в уніфікованих атомних масових одиницях, які абревіатурою позначаються як у. Також не не зустрічається щоб ці одиниці писали як аму, як це було раніше абревіатурою для уніфікованих атомних масових одиниць. Молекулярну масу також можна виміряти в дальтонах, які часто абревіатурою позначаються як Da.
Релевантні терміни:
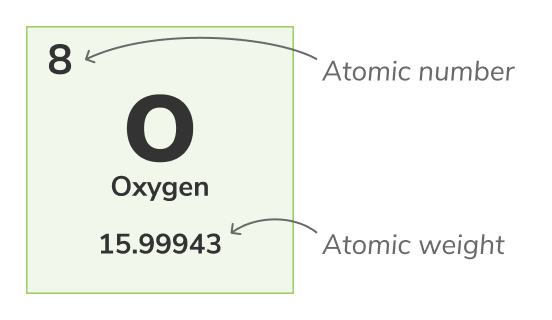
Атомний номер
Атомний число - (також називається протонним числом) число протонів, що знаходяться в ядрі кожного атома хімічного елемента. Він унікально ідентифікує хімічний елемент, наприклад, всі атоми кисню мають 8 протонів. Атомне число зазвичай показують над елементами у періодичній таблиці.Масове число
Масове число - (також називається атомним масовим числом або числом нуклеонів) відноситься до загального числа протонів і нейтронів (разом відомих як нуклеони) в атомному ядрі. Один елемент може мати різні типи ізотопів. Наприклад, кисень може мати масове число або . У всіх його ізотопів є протонів, але різне число нейтронів, або відповідно.Атомна маса
Атомна маса or - це маса атома. Числове значення атомної маси атома майже таке саме, як його значення масового числа. Наприклад, маса кисню- становить 15.99491461956 у.Атомна вага
Атомна вага - (також називається стандартною атомною вагою) це середня вага всіх природних ізотопів атома. Оскільки ізотопи варіюються по вазі, стандартна атомна вага обчислюється, взявши середній із мас всіх ізотопів атома. Наприклад, атоми кисню (O-16) становлять 99.762% від усіх атомів кисню, атоми кисню (O-17) становлять 0.038% від усіх атомів кисню та атоми кисню (O-18) становлять 0.2% від усіх атомів кисню. Атомна вага кисню є середньою з його 3 ізотопів та дорівнює 15.99943 уАтомна вага представлена нижчим числом в періодичній таблиці.