Tiger Algebra Hesap Makinesi
Moleküler kütlenin bulunması
Moleküler Kütle
Moleküler kütle (aynı zamanda moleküler ağırlık, bir molekülün atom ağırlığı, formül kütlesi ve formül ağırlığı olarak da adlandırılır) bir molekülü oluşturan atomların kombine atom ağırlıklarına işaret eder. Atomların sayısı ile onların atom ağırlıklarını çarpıp sonuçları toplayarak bulunabilir.Örneğin, iki Hidrojen atomu, her biri 1.008u atom ağırlığına sahip, ve bir Oksijen atomu, 15.999u ağırlığında, içerir. ’nin moleküler kütlesini bulmak için, 2 Hidrojen atomunun kombine kütlesi olduğu için Hidrojen'in atom ağırlıklarını 2 ile çarpıyoruz ve bunu, ’de sadece bir Oksijen atomu olduğu için Oksijen'in atom ağırlığına ekliyoruz. Bu işlem sonucu 18.015u elde edilir.
Moleküler kütle, u olarak kısaltılan birleşmiş atom kütle birimlerinde ölçülür. Genellikle bu, eski birleşmiş atom kütle birimlerinin kısaltması olan amu olarak da yazılır. Moleküler kütle ayrıca Dalton olarak da ölçülür, bunlar genellikle Da olarak kısaltılır.
İlgili Terimler:
Atom Numarası
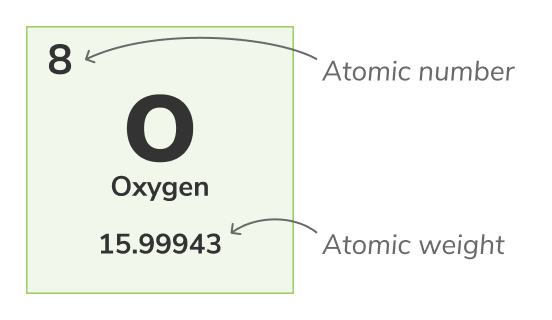
Atom numarası - (proton numarası olarak da adlandırılır) bir kimyasal elementin atomunun çekirdeğinde bulunan protonların sayısıdır. Özgün bir kimyasal elementi tanımlar, örneğin, tüm Oksijen atomlarının 8 protonu vardır. Atom numarası genellikle periyodik tablo’da elementlerin üstünde gösterilir.Kütle Numarası
Kütle numarası - (atom kütle numarası veya nökleon numarası olarak da adlandırılır) bir atomun çekirdeğindeki toplam proton ve nötron sayısına (birlikte nökleon olarak adlandırılır) işaret eder. Bir elementin farklı türlerde izotopları olabilir. Örneğin, Oksijenin kütle numarası veya olabilir. Tüm izotopları protona sahip ancak farklı sayıda nötronlara sahip, sırasıyla or .Atom Kütlesi
Atom kütlesi vaya - bir atomun kütlesidir. Bir atomun atomik kütlesi değeri, kütle numarası değeriyle neredeyse aynıdır. Örneğin, Oksijen-'nın kütlesi 15.99491461956 u'dur.Atomik Ağırlık
Atom ağırlığı - (standart atomik ağırlık olarak da adlandırılır) bir atomun tüm doğal izotoplarının ortalama ağırlığıdır. Çünkü izotoplar ağırlıkta değişiklik gösterir, standart atomik ağırlık bir atomun tüm izotoplarının kütlelerinin ortalamasını alarak hesaplanır. Örneğin, Oksijen (O-16) atomları tüm Oksijen atomlarının %99.762'sini, Oksijen (O-17) atomları tüm Oksijen atomlarının %0.038'ini ve Oksijen (O-18) atomları tüm Oksijen atomlarının %0.2'sini oluşturur. Oksijenin atom ağırlığı 3 izotopunun ortalamasıdır ve 15.99943 u'dur.Atom ağırlığı, periyodik tabloda daha alt numarada temsil edilir.