Калькулятор Tiger Algebra
Нахождение молекулярной массы
Молекулярная масса
Молекулярная масса (также называемая молекулярным весом, атомным весом молекулы, формульной массой и формульным весом) относится к совокупному атомному весу (также называемому стандартным атомным весом) атомов, образующих молекулу. Она может быть найдена путем умножения количества атомов каждого элемента на их атомные веса и суммирования результатов.Например, содержит два атома водорода, каждый с атомным весом 1,008u, и один атом кислорода с атомным весом 15,999u. Чтобы найти молекулярную массу , мы умножаем вес водорода на 2, потому что в два атома водорода и мы должны найти их совокупную массу, и прибавляем к этому вес кислорода, потому что в только один атом кислорода, что дает 18,015u.
Молекулярная масса измеряется в единицах атомной массы, которые обозначаются как u. Не редко их обозначают как amu, так как это было старое обозначение для единиц атомной массы. Молекулярная масса также может быть измерена в дальтонах, которые часто обозначаются как Da.
Соответствующие понятия:
Атомный номер
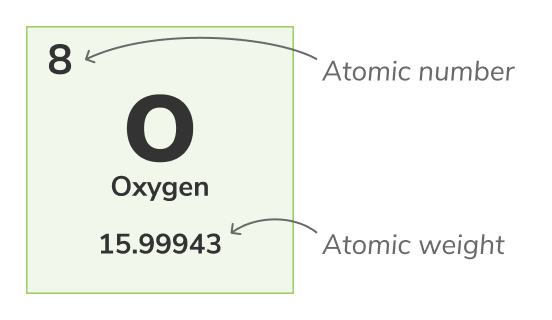
Атомный номер - (также называемый числом протонов) число протонов, находящихся в ядре каждого атома химического элемента. Он уникально идентифицирует химический элемент, например, все атомы кислорода имеют 8 протонов. Атомный номер обычно показывается над элементами в periodic table.Массовый номер
Массовый номер - (также называемый атомным массовым числом или числом нуклонов) относится к общему числу протонов и нейтронов (вместе известных как нуклоны) в атомном ядре. Один элемент может иметь разные виды изотопов. Например, кислород может иметь массовый номер или . Все его изотопы имеют протонов, но разное число нейтронов, или соответственно.Атомная масса
Атомная масса or - это масса атома. числовое значение атомной массы атома почти равно значению его массового числа. Например, масса кислорода- составляет 15,99491461956 u.Атомная вес
Атомная вес - (также называемый стандартный атомный вес) - это средний вес всех натуральных изотопов атома. Поскольку изотопы отличаются по весу, стандартный атомный вес рассчитывается путем усреднения масс всех изотопов атома. Например, атомы кислорода (O-16) составляют 99,762% всех атомов кислорода, атомы кислорода (O-17) - 0,038% всех атомов кислорода, и атомы кислорода (O-18) - 0,2% всех атомов кислорода. Атомный вес кислорода - это среднее значение его 3 изотопов и составляет 15,99943 uАтомный вес представлен наиболее нижним числом в periodic table.