Calculadora Tiger Algebra
Encontrando uma massa molecular
Massa Molecular
A massa molecular (também chamada de peso molecular, peso atômico de uma molécula, massa fórmula, e peso fórmula) refere-se aos pesos atômicos combinados (também chamados de pesos atômicos padrão) dos átomos que compõem uma molécula. Ela pode ser encontrada multiplicando o número de átomos de cada elemento pelos seus pesos atômicos e somando os resultados juntos.Por exemplo, a contém dois átomos de Hidrogênio, cada um com um peso atômico de 1.008u, e um átomo de Oxigênio com peso atômico de 15.999u. Para encontrar a massa molecular da , multiplicamos os pesos atômicos do Hidrogênio por 2, porque existem dois átomos de Hidrogênio na e precisamos encontrar a massa combinada deles, e o adicionamos ao peso atômico do Oxigênio, porque há apenas um átomo de Oxigênio na , chegando a 18.015u.
A massa molecular é medida em unidades de massa atômica unificada, que são abreviadas como u. Também não é incomum vê-las escritas como amu, pois esta era a antiga abreviação para unidades de massa atômica unificada. A massa molecular também pode ser medida em Daltons, frequentemente abreviados como Da.
Termos relevantes:
Número atômico
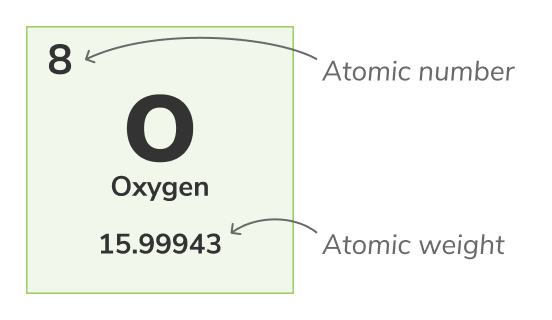
Número atômico - (também chamado de número de prótons) é a quantidade de prótons encontrada no núcleo de cada átomo de um elemento químico. Ele identifica de maneira única um elemento químico; por exemplo, todos os átomos de Oxigênio têm 8 prótons. O número atômico costuma ser mostrado acima dos elementos na tabela periódica.Número de massa
Número de massa - (também chamado de número de massa atômica ou número de nucleons) refere-se ao número total de prótons e nêutrons (juntos conhecidos como nucleons) em um núcleo atômico. Um elemento pode ter diferentes tipos de isótopos. Por exemplo, o Oxigênio pode ter um número de massa de ou . Todos os seus isótopos têm prótons mas diferentes números de nêutrons, ou respectivamente.Massa atômica
Massa atômica ou - é a massa de um átomo. O valor numérico da massa atômica de um átomo é quase o mesmo que o do seu número de massa. Por exemplo, a massa do Oxigênio- é 15.99491461956 u.Peso atômico
Peso atômico - (também chamado de peso atômico padrão) é o peso médio de todos os isótopos naturais de um átomo. Como os isótopos variam em peso, o peso atômico padrão é calculado pela média das massas de todos os isótopos de um átomo. Por exemplo, átomos de Oxigênio (O-16) constituem 99.762% de todos os átomos de Oxigênio, átomos de Oxigênio (O-17) são 0.038% de todos os átomos de Oxigênio e átomos de Oxigênio (O-18) são 0.2% de todos os átomos de Oxigênio. O peso atômico do Oxigênio é a média dos seus 3 isótopos e é igual a 15.99943 uO peso atômico é representado pelo número inferior na tabela periódica.