टाइगर बीजगणित कैलकुलेटर
एक अणु द्रव्यमान खोजना
अणुभार
अणुभार (यह मोलेकुलर वजन, एक अणु का परमाणु भार, सूत्र भार, और सूत्र वजन भी कहलाता है) से अभिप्रेत होता है किसी भी अणु को बनाने वाले परमाणुओं के संयुक्त परमाणु भार (जिसे मानक परमाणु भार भी कहा जाता है)। इसे हम पासकते हैं प्रत्येक तत्व के परमाणुओं की संख्या को उनके परमाणु भारों से गुणाकर और परिणामों को जोड़कर।उदाहरण के लिए, में दो हाइड्रोजन परमाणु होते हैं, प्रत्येक का परमाणु भार होता है 1.008u, और एक ऑक्सीजन परमाणु का परमाणु भार है 15.999u। का अणुभार ज्ञात करने के लिए, हम हाइड्रोजन के परमाणु भार को 2 से गुणांकित करते हैं, क्योंकि में दो हाइड्रोजन परमाणु होते हैं और हमें उनका संयुक्त भार ज्ञात करना है, और उसे ऑक्सीजन के परमाणु भार में जोड़ते हैं, क्योंकि में केवल एक ऑक्सीजन परमाणु होता है, इसे मिलाकर होता है 18.015u।
अणुभार को एकीकृत परमाणु भार इकाइयों में मापा जाता है, जिसे u के रूप में संक्षेपित किया जाता है। यह असामान्य नहीं है कि इन्हें amu के रूप में लिखा जाता है, क्योंकि यह पहले एकीकृत परमाणु भार इकाइयों के लिए संक्षेपीकरण था। अणुभार को Dalton इकाइयों में भी मापा जा सकता है, जो अक्सर Da के रूप में संक्षिप्त किया जाता है।
महत्वपूर्ण शब्दवाली:
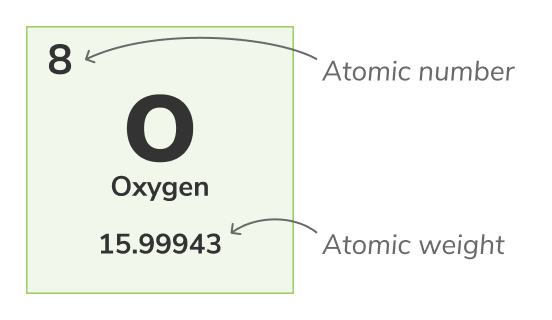
परमाणु क्रमांक
परमाणु क्रमांक - (यह प्रोटॉन संख्या भी कहलाता है) किसी भी रासायनिक तत्व के प्रत्येक परमाणु के नाभिक में पाए जाने वाले प्रोटॉन्स की संख्या। यह एक रासायनिक तत्व की अद्वितीय पहचान करता है, उदाहरण के लिए, सभी ऑक्सीजन के परमाणु में 8 प्रोटॉन होते हैं। परमाणु संख्या का प्रदर्शन सामान्यतः तत्वों के ऊपर पर्यावरणीय सारणी में किया जाता है।द्रव्यमान संख्या
द्रव्यमान संख्या - (इसे परमाणु द्रव्यमान संख्या या न्यूक्लियन संख्या भी कहते हैं) किसी अणु के नाभिक में प्रोटॉन और न्यूट्रॉन (जिन्हें मिलाकर न्यूक्लियन कहते हैं) की कुल संख्या से संदर्भित करता है। एक तत्व में विभिन्न प्रकार के आइसोटोप (सामान्य परमाणु) हो सकते हैं। उदाहरण के लिए, ऑक्सीजन का द्रव्यमान संख्या हो सकता है या । इसके सभी इसोटोपों में प्रोटॉन होते हैं लेकिन न्यूट्रॉनों की संख्या अलग होती है, या क्रमशः।परमाणु भार
... परमाणु भार या - यह एक परमाणु का भार है। किसी परमाणु के परमाणु भार का संख्यात्मक मान लगभग इसकी द्रव्यमान संख्या मान के समान होता है। उदाहरण के लिए, ऑक्सीजन- का द्रव्यमान 15.99491461956 u है।परमाणु वजन
परमाणु वजन - (यह मानक परमाणु वजन भी कहलाता है) किसी परमाणु के सभी प्राकृतिक आइसोटोपों का औसत वजन है। क्योंकि आइसोटोपों का वजन भिन्न होता है, मानक परमाणु वजन को किसी परमाणु के सभी आइसोटोपों के द्रव्यमानों का औसत लेकर गणना किया जाता है। उदाहरण के लिए, सभी ऑक्सीजन परमाणु में ऑक्सीजन (O-16) परमाणु 99.762%, ऑक्सीजन (O-17) परमाणु सभी ऑक्सीजन परमाणु के 0.038% और ऑक्सीजन (O-18) परमाणु सभी ऑक्सीजन परमाणु के 0.2% हैं। ऑक्सीजन का परमाणु वजन इसके 3 आइसोटोपों का औसत है और यह 15.99943 u के बराबर है।परमाणु वजन को पर्यावरणीय सारणी में निचली संख्या द्वारा प्रतिष्ठापित किया जाता है।