מחשבון טייגר אלגברה
Εύρεση μοριακής μάζας
मोलेक्यूलर द्रव्यमान
मोलेक्यूलर द्रव्यमान (जिसे मोलेक्यूलर वजन, एक मोलेक्यूल का परमाणु वजन, सूत्र द्रव्यमान, और सूत्र वजन भी कहा जाता है) उन परमाणुओं के संयुक्त परमाणु वजन (जिसे मानक परमाणु वजन भी कहा जाता है) का संदर्भ देता है जो एक मोलेक्यूल बनाते हैं। यह उन परमाणुओं की संख्या को अपने परमाणु वजन से गुणा करने और परिणामस्वरूप एकत्रित संख्याओं को जोड़ने से पाया जा सकता है।उदाहरण के लिए, में दो हाइड्रोजन परमाणु होते हैं, जिनका प्रत्येक का परमाणु वजन 1.008u होता है, और एक ऑक्सीजन परमाणु जिसका परमाणु वजन 15.999u होता है। का मोलेक्यूलर द्रव्यमान निर्धारित करने के लिए, हम हाइड्रोजन के परमाणु वजन को 2 से गुणा करते हैं, क्योंकि में दो हाइड्रोजन परमाणु होते हैं एवं हमें उनके संयुक्त द्रव्यमान का पता लगाना होता है, और उसे ऑक्सीजन के परमाणु वजन से जोड़ते हैं, क्योंकि में केवल एक ही ऑक्सीजन परमाणु होता है, ताकि हमें 18.015u मिले।
मोलेक्यूलर द्रव्यमान को एकीकृत परमाणु द्रव्यमान इकाई में मापा जाता है, जिसे u के रूप में संक्षेपित किया जाता है। इसे amu के रूप में लिखने को भी असामान्य नहीं माना जाता है, क्योंकि यह एकीकृत परमाणु द्रव्यमान इकाई का पूर्वावली संकेतन था। मोलेक्यूलर द्रव्यमान को डाल्टन में भी मापा जा सकता है, जिसे अक्सर Da के रूप में संक्षेपित किया जाता है।
संबंधित शब्द:
परमाणु संख्या
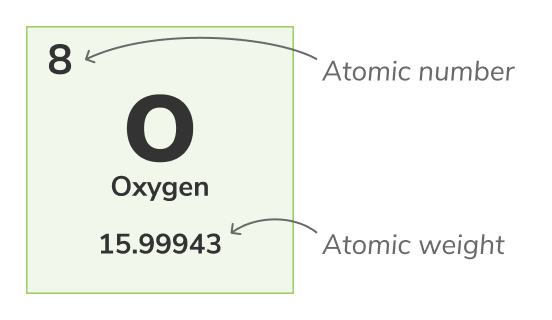
परमाणु संख्या - (जिसे प्रोटॉन संख्या भी कहते हैं) हर रासायनिक तत्व के प्रत्येक परमाणु के नाभिक में पाए जाने वाले प्रोटॉन की संख्या होती है। यह एक रासायनिक तत्व की विशेषता को पहचानती है, उदाहरण स्वरूप, सभी ऑक्सीजन के परमाणु में 8 प्रोटॉन होते हैं। परमाणु संख्या सामान्यत: तत्वों के ऊपर periodic-table में दिखाई जाती है।द्रव्यमान संख्या
द्रव्यमान संख्या - (इसे परमाणु द्रव्यमान संख्या या न्यूक्लीयन संख्या भी कहा जाता है) एक परमाणु नाभिक में प्रोटॉन और न्यूट्रॉन (जिन्हें मिलाकर न्यूक्लीयन कहा जाता है) के कुल संख्या का संदर्भ देता है। एक ही तत्व के विभिन्न प्रकार के आइसोटोप हो सकते हैं। उदाहरण के लिए, ऑक्सीजन की द्रव्यमान संख्या या हो सकती है। सभी इसके आइसोटोप में प्रोटॉन होते हैं लेकिन न्यूट्रॉनों की संख्या अलग-अलग होती है, या संबंधित रूप से।परमाणु द्रव्यमान
परमाणु द्रव्यमान या - एक परमाणु का द्रव्यमान होता है। परमाणु का न्यूमेरिक वैल्यू लगभग उसकी द्रव्यमान संख्या के समान होता है। उदाहरण के लिए, ऑक्सीजन- का द्रव्यमान 15.99491461956 u होता है।परमाणु वजन
परमाणु वजन - (इसे मानक परमाणु वजन भी कहा जाता है) एक परमाणु के सभी प्राकृतिक आइसोटोपों का औसत वजन होता है। क्योंकि आइसोटोप वजन में अलग-अलग होते हैं, मानक परमाणु वजन की गणना एक परमाणु के सभी आइसोटोपों के द्रव्यमान का औसत लेकर की जाती है। उदाहरण के लिए, सभी ऑक्सीजन के परमाणु में से ऑक्सीजन (O-16) परमाणु 99.762% होते हैं, ऑक्सीजन (O-17) परमाणु सभी ऑक्सीजन के परमाणुओं के 0.038% होते हैं और ऑक्सीजन (O-18) परमाणु सभी ऑक्सीजन के परमाणुओं के 0.2% होते हैं। ऑक्सीजन का परमाणु वजन इसके 3 आइसोटोपों का औसत होता है और 15.99943 u के बराबर होता है।परमाणु वजन को periodic-table में निचले अंक द्वारा प्रतिष्ठित किया जाता है।