Calculatrice Tiger Algebra
Trouver une masse moléculaire
Masse moléculaire
La masse moléculaire (également appelée poids moléculaire, poids atomique d'une molécule, masse de formule et poids de formule) fait référence à la combinaison des poids atomiques standards des atomes qui forment une molécule. Elle peut être trouvée en multipliant le nombre d'atomes de chaque élément par leurs poids atomiques et en additionnant les résultats ensemble.Par exemple, contient deux atomes d'Hydrogène, chacun ayant un poids atomique de 1.008 u, et un atome d'Oxygène avec un poids atomique de 15.999u. Pour trouver la masse moléculaire de , nous multiplions les poids atomiques de l'Hydrogène par 2, car il y a deux atomes d'Hydrogène dans et nous devons trouver leur masse combinée, et nous y ajoutons le poids atomique de l'Oxygène, car il y a seulement un atome d'Oxygène dans , pour obtenir 18.015u.
La masse moléculaire est mesurée en unités de masse atomique unifiées, qui sont abrégées en u. Il n'est pas rare de voir ces unités écrites en amu, car c'était l'abréviation des unités de masse atomique unifiées. La masse moléculaire peut également être mesurée en Daltons, souvent abrégés en Da.
Termes pertinents :
Nombre atomique
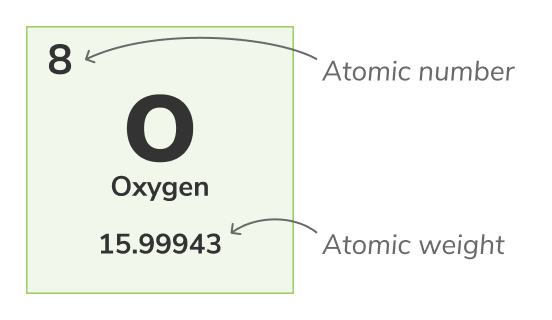
Le nombre atomique - (également appelé nombre de protons) est le nombre de protons trouvés dans le noyau de chaque atome d'un élément chimique. Il identifie de manière unique un élément chimique, par exemple, tous les atomes d'Oxygène ont 8 protons. Le nombre atomique est généralement affiché au-dessus des éléments dans le tableau périodique.Nombre de masse
Le nombre de masse - (également appelé nombre de masse atomique ou nombre de nucléons) se réfère au nombre total de protons et de neutrons (connus ensemble comme les nucléons) dans un noyau atomique. Un élément peut avoir différents types d'isotopes. Par exemple, l'Oxygène peut avoir un nombre de masse de ou . Tous ses isotopes ont protons mais un nombre différent de neutrons, ou respectivement.Masse atomique
La masse atomique ou - est la masse d'un atome. La valeur numérique de la masse atomique d'un atome est presque la même que celle de son nombre de masse. Par exemple, la masse de l'Oxygène- est de 15.99491461956 u.Poids atomique
Le poids atomique - (également appelé poids atomique standard) est le poids moyen de tous les isotopes naturels d'un atome. Parce que les isotopes varient en poids, le poids atomique standard est calculé en prenant la moyenne des masses de tous les isotopes d'un atome. Par exemple, Oxygen (O-16) les atomes représentent 99.762% de tous les atomes d'Oxygène, Oxygen (O-17) les atomes sont 0.038% de tous les atomes d'Oxygène et Oxygen (O-18) les atomes sont 0.2% de tous les atomes d'Oxygène. Le poids atomique de l'Oxygène est la moyenne de ses 3 isotopes et est égal à 15.99943 uLe poids atomique est représenté par le chiffre inférieur dans le tableau périodique.