Tiger Algebra-Rechner
Die Molmasse finden
Molekulare Masse
Die molekulare Masse (auch Molekulargewicht, Atomgewicht eines Moleküls, Formelmasse und Formelgewicht genannt) bezieht sich auf die kombinierten Atomgewichte (auch als Standard-Atomgewichte bezeichnet) der Atome, die ein Molekül bilden. Sie kann gefunden werden, indem die Anzahl der Atome jedes Elements mit ihren Atomgewichten multipliziert und die Ergebnisse zusammengefügt werden.Zum Beispiel enthält zwei Wasserstoffatome, jedes mit einem Atomgewicht von 1.008u, und ein Sauerstoffatom mit einem Atomgewicht von 15.999u. Um die molekulare Masse von zu finden, multiplizieren wir die Atomgewichte von Wasserstoff mit 2, weil es in zwei Wasserstoffatome gibt und wir deren kombinierte Masse herausfinden müssen und wir fügen das Atomgewicht von Sauerstoff hinzu, weil in nur ein Sauerstoffatom vorhanden ist, um 18.015u zu erhalten.
Die molekulare Masse wird in vereinheitlichten Atommasseeinheiten gemessen, die als u abgekürzt werden. Es ist auch nicht ungewöhnlich, diese stattdessen als amu geschrieben zu sehen, da dies die ehemalige Abkürzung für vereinheitlichte Atommasseeinheiten war. Die molekulare Masse kann auch in Dalton gemessen werden, die oft als Da abgekürzt werden .
Relevante Begriffe:
Atomnummer
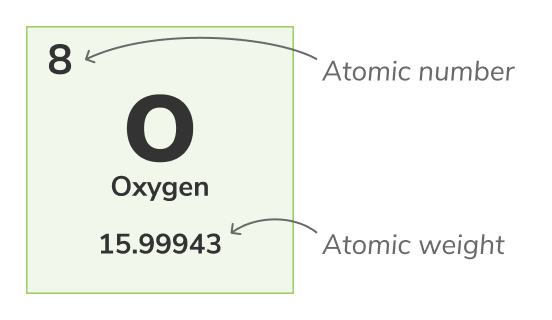
Atomzahl - (auch Protonenzahl genannt) die Anzahl der Protonen, die in jedem Atom eines chemischen Elements gefunden werden. Es identifiziert ein chemisches Element eindeutig, zum Beispiel haben alle Atome von Sauerstoff 8 Protonen. Die Atomnummer wird normalerweise oberhalb der Elemente im angezeigt.Massenzahl
Massenzahl - (auch als Atommasse oder Nukleonzahl bezeichnet) bezieht sich auf die Gesamtzahl an Protonen und Neutronen (zusammen als Nukleonen bezeichnet) in einem Atomkern. Ein Element kann verschiedene Arten von Isotopen haben. Zum Beispiel kann Sauerstoff eine Massenzahl von oder haben. Alle seine Isotope haben Protonen, aber eine unterschiedliche Anzahl von Neutronen, oder entsprechend.Atommasse
Atommasse oder - ist die Masse eines Atoms. Der numerische Wert der Atommasse eines Atoms ist nahezu identisch mit seinem Massenzahlwert. So beträgt die Masse von Sauerstoff- zum Beispiel 15.99491461956 u.Atomgewicht
Atomgewicht - (auch als Standard-Atomgewicht bezeichnet) ist das Durchschnittsgewicht aller natürlichen Isotope eines Atoms. Da Isotope im Gewicht variieren, wird das Standard-Atomgewicht berechnet, indem man den Durchschnitt der Massen aller Isotope eines Atoms nimmt. Zum Beispiel bestehen Sauerstoff -Atome (O-16) zu 99,762% aus allen Sauerstoffatomen, Sauerstoff -Atome (O-17) machen 0,038% aller Sauerstoffatome aus und Sauerstoff -Atome (O-18) machen 0,2% aller Sauerstoffatome aus. Das Atomgewicht von Sauerstoff ist der Durchschnitt seiner 3 Isotope und beträgt 15.99943 uDas Atomgewicht wird durch die untere Zahl im Periodensystem dargestellt.